总胆固醇(Total Cholesterol,TC)是指所有脂蛋白所含胆固醇的总和,包括游离胆固醇(Free Cholesterol,FC)和胆固醇酯(Cholesteryl Ester,CE)。本试剂盒的检测方法是微量法,既可以用可见分光光度计检测,也可以用酶标仪检测。
该产品的最低检出限是0.02 μmol/mL,线性范围为0.03-15 μmol/mL。
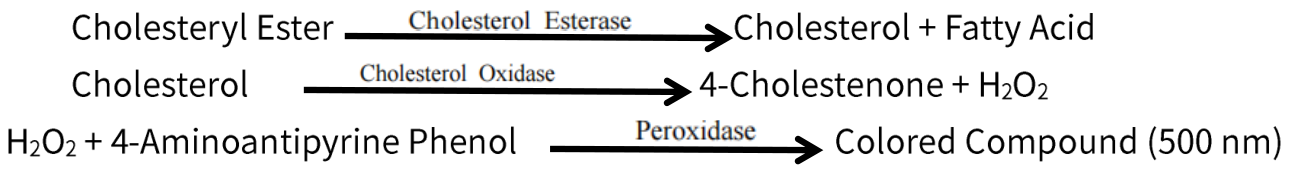
作用原理是通过酯酶催化胆固醇酯水解生成游离胆固醇(FC)和游离脂肪酸(FFA),从而把胆固醇酯转化为FC;进一步利用胆固醇氧化酶催化FC氧化,生成4-胆甾烯酮和H2O2;最后利用过氧化物酶催化H2O2氧化4-氨基安替比林和酚,生成红色醌类化合物,其在500 nm有特征吸收峰,颜色深浅与TC含量成正比。作用方式如下:
测定总胆固醇(TC)请选择60723ES 总胆固醇(TC)含量检测试剂盒;
测定游离胆固醇(FC)请选择60724ES 游离胆固醇(FC)含量检测试剂盒;
测定低密度脂蛋白胆固醇(LDL-C)请选择60736ES 低密度脂蛋白胆固醇(LDL-C)含量检测试剂盒;
测定高密度脂蛋白胆固醇(HDL-C)请选择60737ES 高密度脂蛋白胆固醇(HDL-C)含量检测试剂盒;
胆固醇检测4款相关产品如下:
| 产品货号 | 60723ES | 60724ES | 60736ES | 60737ES |
| 产品名称 | 胆固醇(TC)含量检测试剂盒 | 游离胆固醇(FC)含量检测试剂盒 | 低密度脂蛋白胆固醇(LDL-C)含量检测试剂盒 | 高密度脂蛋白胆固醇(HDL-C)含量检测试剂盒 |
| 功能 | 检测总胆固醇含量 | 检测游离胆固醇含量 | 检测低密度脂蛋白胆固醇含量 | 检测高密度脂蛋白胆固醇含量 |
| 适用场景 | 血清、血浆、细胞、组织等样本中的总胆固醇含量测定,与心脑血管疾病以及多种病理状态密切相关。 | 用于检测血清、血浆、动物组织样本中的游离胆固醇含量。 | 用于动脉粥样硬化的辅助诊断和治疗,评估心血管健康状况和预防心血管疾病。 | 用于体外定量测定血清或血浆中的高密度脂蛋白胆固醇,有助于评估心血管健康状况。 |
组分信息
| 组分编号 | 组分名称 | 规格 | 储存条件 |
| 60723-A | 试剂一 | 60 mL | 2~8℃ |
| 60723-B | 试剂二 | 400 μL | 2~8℃ |
| 60723-C | 试剂三 | 60 μL | 2~8℃ |
| 60723-D | 标准品 | 10 mg | 2~8℃ |
使用说明
【注意事项】实验之前建议选择2-3个预期差异大的样本做预实验,如果样本吸光值不在测量范围内,建议稀释或者增加样本量进行检测。
1. 需自备的仪器和溶剂:
可见分光光度计/酶标仪、天平、低温台式离心机、水浴锅/恒温培养箱、微量玻璃比色皿/96孔板、研钵/匀浆器/细胞超声破碎仪、可调式移液枪、EP管、蒸馏水和异丙醇。
2. 溶液的配制:
1)自备提取液异丙醇:大约需要110 mL,常温保存;试剂盒内提供一个30 mL棕色空瓶,仅做分装使用。
2)标准品溶液的配置:10 mg胆固醇使用前加入517 μL提取液,振荡溶解后即为50 μmol/mL的胆固醇标准溶液,2~8℃可保存4周。
3)试剂三液体置于试剂瓶内EP管中,用前使用离心机将液体离心至底部。
4)工作液的配制:根据样本量将试剂一、试剂二、试剂三按照6 mL、40 μL、6 μL(共6.046 mL,约12T)的比例配制工作液,现配现用。
3. 操作步骤
1)样本处理(可适当调整待测样本量,具体比例可以参考文献)
a. 组织:按照组织质量(g):提取液体积(mL)为 1:5~10 的比例(建议称取约0.1 g组织,加入1 mL提取液)进行冰浴匀浆。10000 g,4℃离心10 min,取上清置冰上待测。
b. 细菌/细胞:按照细胞数量(106个):提取液体积(mL)为 5~10:1的比例(建议500万细菌/细胞加入1 mL提取液),冰浴超声波破碎细菌/细胞(功率300 w,超声2秒,间隔3秒,总时间3 min);然后10000 g,4℃离心10 min, 取上清置于冰上待测。
c. 血清(浆)等液体样本:直接测定,若有沉淀请离心后取上清待测。
2)测定步骤
a. 可见分光光度计/酶标仪预热30 min以上,调节波长至500 nm,分光光度计蒸馏水调零。
b. 工作液临用前37℃预热10 min以上。
c. 标准溶液的稀释:将50 μmol/mL胆固醇标准溶液用提取液进行稀释,得到10、5、2.5、1.25、0.625、0.3125 μmol/mL的标准溶液备用。
c. 标准溶液稀释可参考下表:
| 序号 | 稀释前浓度(μmol/mL) | 标准溶液体积(µL) | 提取液体积(µL) | 稀释后浓度(μmol/mL) |
| 1 | 50 | 100 | 400 | 10 |
| 2 | 10 | 200 | 200 | 5 |
| 3 | 5 | 200 | 200 | 2.5 |
| 4 | 2.5 | 200 | 200 | 1.25 |
| 5 | 1.25 | 200 | 200 | 0.625 |
| 6 | 0.625 | 200 | 200 | 0.3125 |
注:实验中每个标准管需10 µL标准溶液(注意不要在此步骤直接检测吸光度)。
d. 在1.5 mL EP管/96孔板按下表步骤加样:
| 试剂名称(µL) | 测定管 | 标准管 | 空白管 |
| 样本 | 10 | - | - |
| 标准溶液 | - | 10 | - |
| 提取液 | - | - | 10 |
| 工作液 | 500 | 500 | 500 |
| 充分混匀,37℃静置30 min,反应完成后吸取200 μL于微量比色皿/96孔板中,测定500 nm处吸光值A,分别记为A测定、A标准和A空白,ΔA测定=A测定-A空白,ΔA标准=A标准-A空白。空白管和标准曲线只需测1-2次。注:若样本为血清(浆)等液体样本,则需要增加‘血清(浆)空白管’-即将空白管中的提取液(异丙醇)更换为蒸馏水进行实验,计算ΔA 测定=A 测定-A 血清(浆)空白,标准管测定及ΔA 标准计算不变。 | |||
3) 总胆固醇含量计算
a. 标准曲线的绘制:
根据标准管的浓度(x,μmol/mL)和吸光度ΔA标准(y,ΔA标准),建立标准曲线。根据标准曲线,将ΔA测定(y,ΔA测定)带入公式计算样本浓度(x,μmol/mL)。
b. 总胆固醇含量的计算:
(1)按血清(浆)等液体体积计算:TC含量(μmol/dL)=x×100×F
(2)按样本蛋白浓度计算:TC含量(μmol/mg prot)=x×V提取÷(Cpr×V提取)×F=x÷Cpr×F
(3)按样本质量计算:TC含量(μmol/g 质量)=x×V提取÷W×F=x÷W×F
(4)按细胞/细菌数量计算:TC含量(μmol/106 cell)=x×V提取÷N×F=x÷N×F
100:单位换算系数,1 dL=100 mL;V提取:加入样本的提取液体积,1 mL;W:样本质量,g;N:细菌或细胞总数,以106计。Cpr:蛋白浓度,mg/mL;F:样本稀释倍数。
4. 实验实例:
(1)取大鼠血清样本,直接按照测定步骤操作,使用96孔板测得计算ΔA测定=A测定-A空白=0.177-0.044=0.133,根据标准曲线 y=0.066x-0.0069,R2=0.9991,计算 x=2.120,按血清(浆)等液体体积计算含量得:
TC 含量(μmol/dL)=x×100=212.0 μmol/dL。
(2)取0.105 g大鼠肾脏加入1 mL提取液冰浴匀浆,按照测定步骤操作,使用96孔板测得ΔA 测定=A 测定-A 空白=0.124-0.044=0.080,根据标准曲线 y=0.066x-0.0069,R2=0.9991,计算x=1.317,按样本质量计算含量得:
TC 含量(μmol/g 质量)=x÷W =12.543 μmol/g 质量。
(3)取10×106个Hela细胞加入0.5 mL提取液超声破碎,按照测定步骤操作,使用96孔板测得Δ
A 测定=A 测定-A 空白=0.071-0.044=0.027,根据标准曲线 y=0.066x-0.0069,R2=0.9991,计算x=0.514,按细胞数量计算含量得:
TC 含量(μmol/106 cell)= x×V 提取÷N×F =0.026 μmol/10E6 cell
2~8℃保存,有效期6个月。





