FITC,英文全称Fluorescein Isothiocyanate,中文名称异硫氰酸荧光素,具有高吸收率、优良的荧光量子产率和良好的水溶性等特点,是生物学中应用最为广泛的一种绿色荧光素衍生物,其异硫氰酸基团可与蛋白的氨基末端或者伯胺反应从而实现包括抗体,凝集素在内的蛋白标记。除了用作蛋白质标记物,还可用作蛋白质荧光示踪剂,标记抗体用以快速鉴定病原体,以及用于蛋白质和多肽(HPLC)的微量测序。FITC为黄-橙色粉末,最大激发波长为494 nm。一旦激发,在最大发射波长520 nm处呈黄-绿色荧光。
FITC有两种异构体,异构体I(Isomer I)和异构体II(Isomer II),二者在光谱性质上基本没有差异(无论是波长还是光强度),但是前者更易纯化,所以相对便宜,应用也较为广泛。对于大部分应用,混合型的FITC已能很好的满足实验要求。本品Isomer I含量≥90%,适合用于蛋白质标记。
本产品是一种常用的荧光标记试剂。
- 荧光特性:在激发光下发出明亮的绿色荧光,激发波长约为494 nm,发射波长约为521 nm。
- 高灵敏度:荧光强度高,适用于低浓度样品的检测。
- 生物相容性:对生物体系低毒性,适用于细胞和生物分子的标记。
- 广泛用途:常用于免疫荧光、流式细胞术、荧光显微镜等实验。
使用方法
1. 标记蛋白
1)制备溶于0.1 M碳酸钠缓冲液(pH 9)的待交联蛋白样品,浓度≥2 mg/mL。
【注】:a)勿将碳酸钠-碳酸氢钠缓冲液存放于0-5℃超过1周,其pH值会发生变化,建议现配现用。
b)待标记的蛋白必须是未被污染蛋白,且溶解蛋白的缓冲液里不能含有叠氮钠或胺类试剂,如Tris、甘氨酸,因为这些试剂会抑制标记反应。如果缓冲液里含有上述试剂,则需将该蛋白溶液在4℃下于PBS,pH 7.4 透析过夜;透析过程中如果pH值过高(>8.0-8.5)会损害某些蛋白。
2)溶解FITC于无水DMSO配制成浓度为1 mg/mL的溶液。
【注】:于标记实验前新鲜配置FITC溶液,避光。
3)对于1 mL 蛋白溶液加入50 µLFITC溶液,可按照每次5 µL的量边加边轻轻搅拌蛋白溶液;
4)待所需FITC加入完毕,将反应液于4℃避光孵育8 h;
5)加入NH4Cl使其终浓度至50 mM,4℃终止反应2 h;
6)加入二甲苯青至浓度0.1%,甘油至浓度5%;
7)通过大小孔径合适的凝胶过滤层析分离排除未被结合的FITC,待凝胶柱平衡后,将以上反应混合液从柱顶注入,打开凝胶柱,待其全部流入柱床后,加入PBS缓冲液。
此时,可以形成两条带:a,快速移动带,也就是FITC-蛋白偶联物,先被洗脱,通常于室内光下可看到;b,慢速移动带,也就是未结合蛋白的FITC和二甲苯青。仅仅在PBS缓冲液清洗后被洗脱出来。
8)于4℃避光储存上述偶联物,加入0.1%(w/v)叠氮化钠作为一种防腐剂。若蛋白浓度较低(<1 mg/mL),可加入1%BSA作为一种蛋白稳定剂。
9)偶联物中荧光素和蛋白的比值(F/P)可通过测定495 nm和280 nm处的吸光值来鉴定,F/P应位于0.3-1.0。小于该比例则信号太低,高于该比例则背景太高。
2. 荧光素/蛋白摩尔比(F/P)的测定
F/P摩尔比即荧光素蛋白偶联物中FITC与蛋白质的摩尔比。为了计算该值,首先需测定该偶联物在280nm和495nm的吸光值:将已标记蛋白样品置于石英比色皿中,测得A280和A495,注意A280的值需在0.2-1.4之间,如在该范围外,需调整相应标记样品浓度。
2.1 对FITC-IgG标记物
F/P摩尔比计算公式为:Molar F/P=[2.77×A495] / [A280-(0.35×A495)]
FITC-IgG偶联物浓度计算公式为:IgG(mg/ml)=[A280-(0.35×A495)] / 1.4
【注】:该处1.4,指的是大多数物种IgG 以浓度为1mg/ml在pH7.0的条件下测得的A280为1.4。
2.2 对于其他FITC-蛋白质(非IgG)偶联物
F/P摩尔比计算公式为
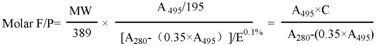 此处 ,
此处 ,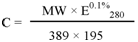
【注】:C对一种蛋白质而言是一常数;
MW是蛋白质分子量;
389是FITC的分子量;
195是FITC偶联物在pH13, 490 nm处的吸光值E0.1%;
(0.35×A495)是基于FITC A280的校正因子;
E0.1%是某一蛋白(1.0 mg/mL)在280 nm处的吸光值
- 生物化学:用于标记抗体、蛋白质和核酸,用于免疫荧光和流式细胞术。
- 细胞生物学:用于细胞标记和荧光显微镜观察。
- 分析化学:用于荧光探针和传感器的开发。
冰袋运输。4℃干燥避光保存,2年有效。
[1] Lin Y, Yang Y, Yuan K, et al. Multi-omics analysis based on 3D-bioprinted models innovates therapeutic target discovery of osteosarcoma. Bioact Mater. 2022;18:459-470. Published 2022 Mar 29. doi:10.1016/j.bioactmat.2022.03.029(IF:14.593)
[2] Zhang P, Qiu Y, Wang Y, et al. Nanoparticles Promote Bacterial Antibiotic Tolerance via Inducing Hyperosmotic Stress Response. Small. 2022;18(19):e2105525. doi:10.1002/smll.202105525(IF:13.281)
[3] Hu Q, Jia L, Zhang X, Zhu A, Wang S, Xie X. Accurate construction of cell membrane biomimetic graphene nanodecoys via purposeful surface engineering to improve screening efficiency of active components of traditional Chinese medicine. Acta Pharm Sin B. 2022;12(1):394-405. doi:10.1016/j.apsb.2021.05.021(IF:11.614)
[4] Yang Y, Hu D, Lu Y, et al. Tumor-targeted/reduction-triggered composite multifunctional nanoparticles for breast cancer chemo-photothermal combinational therapy. Acta Pharm Sin B. 2022;12(6):2710-2730. doi:10.1016/j.apsb.2021.08.021(IF:11.614)
[5] Zhao X, Zhou C, Lvov Y, Liu M. Clay Nanotubes Aligned with Shear Forces for Mesenchymal Stem Cell Patterning. Small. 2019;15(21):e1900357. doi:10.1002/smll.201900357(IF:10.856)
[6] Fan W, Zhang S, Wu Y, et al. Genistein-Derived ROS-Responsive Nanoparticles Relieve Colitis by Regulating Mucosal Homeostasis. ACS Appl Mater Interfaces. 2021;13(34):40249-40266. doi:10.1021/acsami.1c09215(IF:9.229)
[7] Wu D, Zhu ZQ, Tang HX, et al. Efficacy-shaping nanomedicine by loading Calcium Peroxide into Tumor Microenvironment-responsive Nanoparticles for the Antitumor Therapy of Prostate Cancer. Theranostics. 2020;10(21):9808-9829. Published 2020 Aug 2. doi:10.7150/thno.43631(IF:8.579)
[8] Gao H, Tian Q, Zhu L, Feng J, Zhou Y, Yang J. 3D Extracellular Matrix Regulates the Activity of T Cells and Cancer Associated Fibroblasts in Breast Cancer. Front Oncol. 2021;11:764204. Published 2021 Dec 9. doi:10.3389/fonc.2021.764204(IF:6.244)
[9] Cheng Y , Yang Q , Lu Y , et al. A femtosecond Bessel laser for preparing a nontoxic slippery liquid-infused porous surface (SLIPS) for improving the hemocompatibility of NiTi alloys. Biomater Sci. 2020;8(23):6505-6514. doi:10.1039/d0bm01369b(IF:6.183)
[10] Long Z , Wu YP , Gao HY , et al. In vitro and in vivo toxicity evaluation of halloysite nanotubes. J Mater Chem B. 2018;6(44):7204-7216. doi:10.1039/c8tb01382a(IF:4.776)
[11] Tan C, Zheng J, Feng Y, Liu M. Cell Membrane-Coated Halloysite Nanotubes for Target-Specific Nanocarrier for Cancer Phototherapy. Molecules. 2021;26(15):4483. Published 2021 Jul 25. doi:10.3390/molecules26154483(IF:4.412)
[12] Zeng Y, Shi XB, Yuan ZY, et al. Biological characteristics of renal cancer cells after CTP-mediated cancer suppressor gene NPRL2 protein treatment. Biol Chem. 2016;397(11):1163-1171. doi:10.1515/hsz-2016-0143(IF:2.710)
[13] Wu X, Jiang L, Zhang Z, et al. Pancreatic cancer cell apoptosis is induced by a proteoglycan extracted from Ganoderma lucidum. Oncol Lett. 2021;21(1):34. doi:10.3892/ol.2020.12295(IF:2.311)





